11. Klasse (Nordkoordinaten)
I. Aromaten
Frage A1: Substituenten können großen Einfluss auf die Aktivität eines Benzolringes nehmen. Gib zu diesen Substituenten an, ob sie +M-, -M-, +I- oder -I-Effekt besitzen.
| |
+M |
-M |
+I |
-I |
| -OH |
3 |
6 |
4 |
5 |
| -Br |
9 |
4 |
2 |
1 |
| -NO2 |
4 |
7 |
8 |
7 |
| -C2H5 |
4 |
6 |
3 |
2 |
| =O |
2 |
1 |
6 |
8 |
a1 ist die Summe aller angekreuzten Zahlen.
Frage A2: Delokalisierte Elektronen werden oft mit einem griechischen Buchstaben assoziiert. Runde diesen Buchstaben auf eine ganze Zahl, dies ist a2.
Frage A3: An Phenol soll ein weiterer Substituent (elektrophil) zweitsubstituiert werden. Dabei sind grundsätzlich ortho- (1), meta- (2) oder para-Stellung (3) denkbar. Sortiere diese Positionen absteigend hinsichtlich der Wahrscheinlichkeit, dass an dieser Stelle substituiert wird. Du erhältst eine dreistellige Zahl (z.B. 231). Diese ist a3.
Frage A4: Anilin ist nur eine sehr schwache Base (“Anilin hats echt nicht drauf!”), vergleicht man es mit beispielsweise Ammoniak. Es ist ein starkes Blutgift (oxidiert das Eisen(II)-ion im Hämoglobin zu Fe3+) und wirkt karzinogen. Mit welchem “Tier” kann man Anilin deshalb in Verbindung bringen?
- Goldfisch (1)
- Esel (2)
- Krebs (3)
- Maus (4)
- Lachs (5)
- Katze (6)
- Quastenflosser (7)
- Albatross (8)
- Rührfischli (9)

Die entsprechende Nummer ist a4.
A = a1 + a2 + a3 + a4
II. Farbstoffe
Frage B1: In der Schule haben wir folgenden Versuch durchgeführt: In einen Standzylinder wird Tomatensaft (enthält den Farbstoff Lycopin) und Bromwasser gegeben.
Zu erwartende Beobachtung (falls der Versuch funktionert…):
- Das Gemisch entfärbt sich. (3)
- Das Gemisch verändert die Farbe ins Grüne. (6)
- Das Gemisch explodiert. (9)
Woran liegt das?
- Bathochromer Effekt (2)
- Hypsochromer Effekt (4)
- Doppler-Effekt (6)
Das Produkt der beiden Lösungszahlen ist b1.
Frage B2: Indigo ist ein blauer Farbstoff, der durch das Färben von Jeans bekannt wurde. Um Textilien damit zu färben, muss Indigo aber zuerst in die schwach gelbe Leukoform reduziert werden, bevor damit gefärbt werden kann. Warum?
- Indigo ist wasserlöslich und würde sich gleich wieder herauswaschen. (4)
- Indigo ist nicht wasserlöslich und lässt sich deshalb nicht in die Textilien hineinwaschen. (8)
Die Lösungsnummer ist b2.
Frage B3: Welcher dieser Farbstofftypen besitzt einen Anker?
- Direktfarbstoff (3)
- Küpenfarbstoff (5)
- Ionischer Farbstoff (7)
- Reaktivfarbstoff (9)
Die Lösungsnummer ist b3.
B = b1 + b2 + b3
III. Kunststoffe
Frage C1: Getränkeflaschen bestehen meist aus Polyethylenterephthalat (PET). Dieses wird in einer
- Polymerisation (1)
- Polykondensation (2)
- Polyaddition (3)
aus Ethandiol und Terephthalsäure synthetisiert. Die Lösungsnummer ist c1.
Frage C2: Berechne die Molmasse einer Repetiereinheit von PET. Das Ergebnis auf Hunderter gerundet ist c2.
C = c1 + c2
IV. Fette und Tenside
Frage D1: Eine Packung Butter (250g) kann 62,5g Iod addieren. Berechne die Iodzahl von Butter, diese ist d1.
Frage D2: Zur Bestimmung der Verseifungszahl wurden 3g Rindertalg mit 25ml Kalilauge gekocht. Die anschließende titrimetrische Bestimmung ergibt, dass dabei 5,25 * 10-3 mol KOH verbraucht wurden. Berechne die Verseifungszahl von Rindertalg und runde auf Hunderter, dieser Wert ist d2.
Frage D3: Tenside haben folgende Wirkung (Mehrfachantwort möglich):
- emulgierend (4)
- suspendierend (6)
- dispergierend (8)

Die Summer aller richtigen Lösungen ist d3.
D = d1 + d2 + d3
V. Kohlenhydrate
Frage E1: Wie viele Kohlenstoffatome enthält der Ring einer Furanose? Dies ist e1.
Frage E2: D-Milchsäure besitzt einen spezifischen Drehwinkel von -2,6°. Welchen Drehwinkel hat das Enantiomer der D-Milchsäure? Auf eine ganze Zahl gerundet erhältst du e2.
Frage E3: Oftmals verstecken sich hinter Zuckern mit verschiedenen Namen die gleichen Moleküle. Wieviele der folgenden Moleküle beschreiben Glucose? Die Anzahl ist e3.
- Traubenzucker
- Saccharose
- Dextrose
- (2R,3S,4R,5R)-1,2,3,4,5-Pentahydroxyhexanal
- Stärkezucker
Frage E4: Führt man mit Fructose die Fehling-Probe durch, so erhält man ein positives Ergebnis, obwohl Fructose eigentlich gar keine Aldehydgruppe besitzt, die hier nötig wäre. Betrachtet man aber, wie sich die Molekülstruktur von Fructose in basischer Lösung verändern kann, so stellt man verblüfft fest: "Das sieht ja aus wie ...
- ... Maltose!" (5)
- ... Threose!" (6)
- ... Glucose!" (7)
- ... Trinitrotoluol/TNT!" (8)
- ... Cellobiose!" (9)
Die Lösungsziffer ist e4.
Frage E5: Bei der Silberspiegelprobe wird die oxidierte Form eines Metalls zum ungeladenen Element reduziert. Die Ordnungszahl dieses Elements ist e5.
E = e1 + e2 + e3 + e4 + e5
VI. Proteine
Frage F1: Die natürlichen Aminosäuren sind alle
- α-Aminosäuren
- β-Aminosäuren
- γ-Aminosäuren
- δ-Aminosäuren
- ε-Aminosäuren
Die Stellung des griechischen Buchstabens im griechischen Alphabet ist f1.
Frage F2: Aminosäuren können sich über eine Peptid-Bindung miteinander verbinden. Ab 100 Aminosäuren spricht man von einem Protein. Eine derartige Bindung ist uns (unter anderem Namen) bereits vorher im Jahr in einem anderen Kapitel begegnet. Die Kapitelnummer (siehe römische Zahl) ist f2. (Beispiel: Wenn es das Kapitel über Aromaten war, dann ist f2=1)
Frage F3: Welche der Alternativen enthält mehr Eiweiß = Protein? Die Lösungsziffer ist f3.
F = f1 + f2 + f3
VII. Reaktionsgeschwindigkeit und Enzymkatalyse
Frage G1: Bei der Angabe einer Reaktionsgeschwindigkeit muss zwischen momentaner und mittlerer Reaktionsgeschwindigkeit unterschieden werden. Welche davon kann in einem t-n-Diagramm mathematisch als Ableitung beschrieben werden? Die Lösungsziffer ist g1.
- momentane Reaktionsgeschwindigkeit (3)
- mittlere Reaktionsgeschwindigkeit (6)
Frage G2: Die Aktivität von Enzymen kann auf verschiedene Arten und Weisen gehemmt werden. Beispiele dafür sind zum Beispiel die allosterische und die kompetitive Hemmung. Es wird eine dieser Möglichkeiten betrachtet: Je mehr die Substratkonzentration erhöht wird, desto mehr nähert sich die Reaktionsgeschwindigkeit dem Wert an, der ohne den entsprechenden Inhibitor entstehen würde. Um welche Art der Hemmung handelt es sich? Die Lösungsziffer ist g2.
- kompetitive Hemmung (1)
- allosterische Hemmung (5)
G = g1 + g2
12. Klasse (Ostkoordinaten)
VIII. Chemische Gleichgewichte
Frage H1: Das Gleichgewicht, dass sich einstellt, wenn Wasserstoff und Brom exotherm zu Bromwasserstoff reagieren, hat eine Gleichgewichtskonstante von 40. Alle beteiligten Stoffe sind gasförmig. Wenn am Anfang der Reaktion (Volumen 1l) 2mol Wasserstoff und 0,8mol Brom vorhanden sind, wie viele Mol Brom liegen dann im Gleichgewicht vor? Runde auf eine Nachkommastelle und lasse das Komma weg, du erhältst h1.
Frage H2: Es geht wieder um obiges Gleichgewicht. Entscheide, in welche Richtung sich die Gleichgewichtslage bei bestimmten äußeren Zwängen verschiebt. Falls es die Reaktion nicht beeinflusst, kreuze nichts an.
| ... führt zur Verschiebung der GGW-Lage nach ... |
links |
rechts |
| Temperaturerhöhung |
5 |
9 |
| Temperaturerniedrigung |
6 |
2 |
| Druckerhöhung |
8 |
7 |
| Druckerniedrigung |
1 |
6 |
| Stoffmengenerhöhung von Wasserstoff |
9 |
1 |
| Stoffmengenerniedrigung von Bromwasserstoff |
3 |
7 |
| Stoffmengenerniedrigung von Brom |
7 |
6 |
| Katalysator |
4 |
7 |
Die Summe der Zahlen in angekreuzten Feldern ist h2.
H = h1 + h2
IX. Säure-Base-Reaktionen
Frage I1: Die Konzentration von Schwefelsäure in wässriger Lösung beträgt 0,1 mol/l. Berechne den pH-Wert der Lösung, wenn man davon ausgeht, dass H2SO4 vollständig zu 2 H+ + SO42- reagiert. Runde den pH-Wert auf eine Nachkommastelle und lasse das Komma weg, du erhältst i1.
Frage I2: Blausäure wird mit Kalilauge titriert. Wähle aus den folgenden einen geeigneten Indikator aus. Die Lösungsziffer ist i2.
- Phenolphtalein (1)
- Fenolphtalein (2)
- Phenolpthalein (3)
- Phenolfthalein (4)
- Phenolphthalein (5)
- Phenolphphalein (6)
- Phenolftalein (7)
- Phenolphtahlein (8)
- Pfenolpfpfdalein (9)
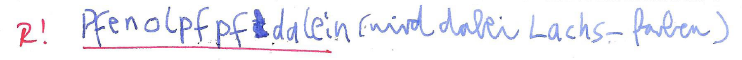
Frage I3: Zu 100ml Essigsäurelösung (pKs = 4,76) wird 40ml Kalilauge gegeben (Konzentration jeweils 0,1mol/l). Berechne den pH-Wert der Lösung unter der Annahme, dass hier ein Puffer gebildet wird. Runde auf eine Nachkommastelle und lasse das Komma weg, du erhältst i3.

I = i1 + i2 + i3
X. Redoxreaktionen
Frage J1: Reagieren die jeweiligen Stoffe miteinander? Die Summe der jeweiligen Ziffern der freiwillig ablaufenden Reaktionen ist j1.
- (1) Fe + Ag+
- (2) Pb + Zn2+
- (3) Sn + Ag+
- (4) Au + Li+
- (5) Ca + Pt2+
- (6) Pt + Ca2+
- (7) Ag + Al3+
Frage J2: Es wird ein galvanisches Element mit den Redoxpaaren Zn/Zn2+ (E0 = -0,76V) und Cr3+/Cr2O72- (E0 = 1,36V) betrachtet. Die Zinkionen haben eine Konzentration von 0,1mol/l, die Chromionen 0,2mol/l, die Dichromationen 0,3mol/l. Die Leerlaufspannung beträgt 1,6V. Welchen pH-Wert hat die Lösung in der Cr3+/Cr2O72--Halbzelle? Hinweis: Ausgleich im Sauren. Der auf ganze Zahlen gerundete pH-Wert ist j2.
Frage J3: Womit kann man einen Gegenstand vor Korrosion schützen? Die Lösungsziffer ist j3.
- Opfer-Anode (2)
- Lachs-Kathode (3)
- Penner-Elektrode (4)
- Streber-Anode (5)
- Lauch-Kathode (6)
- Lappen-Elektrode (7)
J = j1 + j2 + j3
XI. Zusatz-Fragen
Frage K1: Ein Hanuta hat eine quadratische Grundfläche mit Seitenlänge 55mm und ist 14mm hoch. Wieviele Hanutas bräuchte man rechnerisch, um einen Kubikmeter-Hanuta-Würfel zu bauen? Teile die Zahl durch tausend und runde auf eine ganze Zahl, dies ist k1.
Frage K2: Wenn ein Hanuta einen Brennwert von 110kcal hat, welchen Energiegehalt hat der Kubikmeterwürfel? Der auf ganze Gigajoule gerundete Wert ist k2.
Frage K3: Im Chemiekurs sind 20 Schüler, die in der letzten Klausur einen Notenschnitt von 9,15 Punkten erreicht haben. Darunter waren vier Schüler, die leer abgegeben haben. Berechne den "richtigen" Notenschnitt ohne diese vier Schüler. Der Schnitt auf ganze Notenpunkte gerundet ist k3.
K = k1 + k2 + k3
|