Certains phénomènes naturels, d'apparence paradoxale, ne manquent
pas d'intriguer encore nos contemporains ; c'est le cas, par
exemple, des glacières naturelles (ou "trous à
glace") que l'on rencontre parfois dans des grottes : on y voit
se former de la glace en été, pendant les fortes chaleurs qui
règnent à l'extérieur.
En France même, ces glacières ne sont pas rares, nous les
trouvons dans le Doubs, le Vercors ou les Pyrénées; d'autres ont
été signalées en Auvergne.
Près de Clermont-Ferrand, on trouve de telles grottes dans les
coulées de lave que les Auvergnats appellent des "cheires":
l'une est visible près du lac de La Cassière (Cheires des puys de
la Vache et Lassolas), d'autres se trouvent dans la cheire de Côme
(Pontgibaud ,voir aussi GC1WJWH).

Comment expliquer ce phénomène paradoxal : la formation de glace
en été ?
Il nous faut faire appel pour cela à quelques notions de
physique.
Tout le monde a remarqué qu'un bloc de glace, même exposé au
soleil, fond très lentement, surtout s'il est enveloppé dans un
papier mouillé. La cause en est que pour faire passer un corps de
l'état solide à l'état liquide (sans changement de température) il
faut lui fournir une quantité de chaleur (chaleur latente de
fusion).
De même, il faut fournir une quantité de chaleur pour faire
passer de l'état liquide à la vapeur. Par exemple, à 100 °C, sous
la pression normale, la vaporisation d'une masse d'eau liquide
exige une quantité de chaleur environ 540 fois plus grande que
celle qui est nécessaire pour élever la température de 1°C de la
même masse d'eau liquide prise à la température ambiante. La
vaporisation de l'eau, quelle que soit la température à laquelle
elle se produit, absorbe beaucoup de chaleur qu'elle prélève dans
le milieu ambiant qui se refroidit ainsi. Cette propriété permet
d'expliquer un certain nombre de phénomènes courants : lors des
fortes chaleurs, notre organisme se protège en éliminant de la
sueur qui, en s'évaporant, rafraichit la peau. Tout le monde
savait, avant l'existence des réfrigérateurs, que pour rafraîchir
l'eau, il suffisait de la placer dans un récipient poreux (par
exemple les alcarazas des pays chauds) et de favoriser son
évaporation dans un courant d'air. Il nous faut rappeler ici
quelles sont les circonstances qui influent sur l'évaporation d'un
liquide : celle-ci augmente avec la température ; elle dépend aussi
de la proportion de vapeur dans l'atmosphère ambiante :
l'évaporation augmente lorsque cette proportion de vapeur diminue,
il en résulte que, si on maintient cette pression partielle faible
en éliminant la vapeur produite, on accélère l'évaporation. De
plus, l'évaporation augmente avec la surface de liquide avec
l'atmosphère.
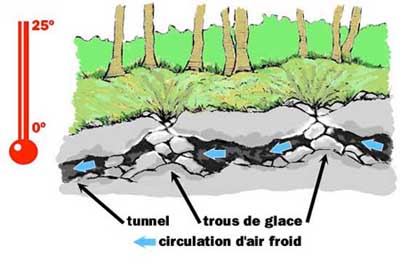
Ces propriétés permettent d'expliquer pourquoi un courant
d'air qui déplace la vapeur produite rafraîchit une peau couverte
de sueur, pourquoi le linge sèche plus vite en cas de vent sec,
pourquoi il arrive qu'un carburant gèle,... et pourquoi on observe
des glacières naturelles en été. En effet, des différences de
températures importantes existent entre l'intérieur et l'extérieur
des grottes, ce qui génère des courants d'air. Si l'atmosphère de
la grotte est très humide, l'eau se dépose sur les parois froides.
Dans certains cas la nature de la paroi, plus ou moins poreuse
(comme c'est le cas des roches des cheires auvergnates) offre une
grande surface d'évaporation, de sorte que l'eau évaporée prélève
beaucoup de chaleur dans le milieu ambiant et en particulier, dans
l'eau disponible. Une partie de l'eau est alors susceptible de se
congeler. Cette opération est facilitée par le fait que la chaleur
latente de solidification (qui est égale à la chaleur latente de
fusion) est environ 7 fois plus faible que la chaleur latente de
vaporisation : ainsi, une masse d'eau en se vaporisant permet,
théoriquement, la congélation d'une masse beaucoup plus grande
d'eau et ce, malgré les échanges thermiques avec le milieu
extérieur qui se produisent inévitablement.